
망간(Mn) 제거 기법이란?
망간 제거 기법은 원수에 대한 망간을 제거하여 최종적으로 맑은 물을 생산하기 위한 방법입니다.
산화법, 접촉여과법, 이온교환법 등이 있습니다.
정수장에서 망간을 제거하는 기법은 다양하며, 사용되는 방법은 원수의 성질, 망간의 농도, 처리해야 할 물의 양 등에 따라 달라질 수 있습니다.
망간(Mn) 제거 기법의 종류
| 망간 제거 기법의 종류 | 설명 |
|---|---|
| 1. 산화법 | 망간을 불용성 화합물로 산화시킨 후 제거하는 방법. 자연적인 공기 산화나 화학적 산화(염소, 오존, 과망간산칼륨 사용 등)를 포함합니다. |
| 2. 접촉여과법 | 산화된 망간을 필터를 통해 직접 제거하는 기술입니다. 산화와 여과가 동시에 이루어지는 경우가 많습니다. |
| 3. 이온교환법 | 망간 이온을 수중에서 제거하기 위해 이온교환 수지를 사용하는 방법입니다. 주로 낮은 농도의 망간 처리에 효과적입니다. |
| 4. 역삼투(RO, Reverse Osmosis) | 매우 세밀한 멤브레인을 사용하여 물과 불순물을 분리하는 방법으로, 망간뿐만 아니라 다른 미네랄과 불순물도 함께 제거할 수 있습니다. |
| 5. 망간 전용 제거제 사용 | 망간을 특정 화학물질이나 제거제로 타겟팅하여 불용성 물질로 변환시킨 후 쉽게 필터링할 수 있게 하는 방법입니다. |
| 6. 생물학적 처리 | 망간을 산화할 수 있는 특정 미생물을 활용하는 친환경적이고 지속 가능한 방법입니다. |
아래에 1~3의 산화법과 접촉여과법 및 이온교환법에 대해 설명하겠습니다.
산화법
이 방법은 망간을 산화시켜 불용성 화합물로 전환시킨 후, 여과 과정을 통해 제거하는 방법입니다.
산화는 자연적인 방법(공기를 이용한 산화) 또는 화학적인 방법(염소, 오존, 과망간산칼륨 등을 사용한 산화)으로 이루어질 수 있습니다.
공기폭기
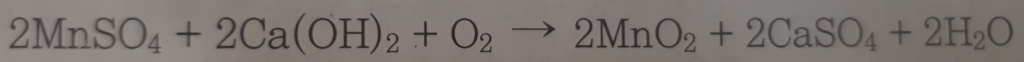
공기폭기는 물 속에 존재하는 철, 망간, 황화수소와 같은 불순물을 제거하는 데 효과적인 방법 중 하나입니다. 이 과정에서, 물에 공기를 주입하여 산소를 포화시키고, 물 속의 불순물을 산화시킵니다.
산화된 불순물은 그 후에 필터를 통해 제거됩니다. 공기폭기는 특히 물의 맛과 냄새를 개선하는 데에도 유용합니다.
공기폭기의 원리
- 공기 주입: 공기폭기는 물에 직접 공기를 주입하거나, 물을 공기 중으로 분사하여 공기와 접촉시키는 방식으로 작동합니다. 이 과정에서 물은 산소를 포화시키게 됩니다.
- 산화: 공기 중의 산소는 물 속의 철, 망간, 황화수소와 같은 불순물과 반응하여, 이들을 불용성 화합물로 변환시킵니다. 이러한 불용성 화합물은 물에서 쉽게 분리될 수 있습니다.
- 분리: 산화된 불순물은 이후에 여과 과정을 통해 물에서 제거됩니다. 여과는 모래 필터, 멤브레인 필터, 혹은 다른 타입의 필터를 사용할 수 있습니다.
공기폭기의 장점
아래는 공기폭기의 장점입니다.
- 물질 제거: 철, 망간, 황화수소 등 다양한 물질을 효과적으로 제거할 수 있습니다.
- 맛과 냄새 개선: 물의 맛과 냄새를 개선하여 더 좋은 식수 품질을 제공합니다.
- 환경 친화적: 화학물질의 사용을 줄이면서 처리할 수 있어 환경에 덜 해롭습니다.
공기폭기 시스템 설계 시 고려사항
충분한 산화 시간을 확보하고, 적절한 여과 시스템을 구비해야 합니다. 또한, 공기폭기를 통해 제거되지 않는 불순물이 있을 수 있으므로, 경우에 따라 추가 처리 과정이 필요할 수 있습니다.
염소산화

염소산화는 물 처리 과정에서 흔히 사용되는 소독 방법 중 하나입니다. 이 방법은 주로 물에 있는 유해한 미생물을 살균하고, 맛과 냄새를 개선하기 위해 사용됩니다.
염소산화는 염소 또는 염소 화합물(예: 염소 가스, 차아염소산 나트륨, 차아염소산 칼슘 등)을 물에 첨가하여 진행됩니다. 염소산화 과정은 다음과 같습니다.
염소산화 과정
- 염소 첨가: 염소 또는 염소 화합물을 물에 첨가합니다. 염소의 형태는 처리하려는 물의 유형, 처리 목적, 처리 시설의 규모 등에 따라 다를 수 있습니다.
- 반응: 첨가된 염소는 물 속의 유기물, 미생물과 반응하여 이들을 살균하거나 제거합니다. 이 과정에서 염소는 미생물의 세포벽을 파괴하거나 효소 활동을 방해하여 미생물을 비활성화시킵니다.
- 부산물 형성: 염소는 물 속의 유기물과 반응하여 다양한 부산물을 형성할 수 있습니다. 이러한 부산물 중 일부는 인체에 유해할 수 있으므로, 염소 사용 시에는 이러한 부산물의 형성을 최소화하는 것이 중요합니다.
염소산화의 장단점
염소산화의 장점은 효과적인 살균 능력과 비교적 저렴한 비용, 사용의 용이성 등입니다.
그러나 염소산화 과정에서 유해한 부산물이 형성될 수 있으며, 일부 미생물(예: Cryptosporidium)은 염소에 대한 내성을 가질 수 있어, 이러한 경우에는 추가적인 처리 방법이 필요할 수 있습니다.
이산화염소산화

이산화염소(ClO2) 산화는 수처리 공정에서 흔히 사용되는 또 다른 방식으로, 특히 염소 대비 몇 가지 이점이 있습니다.
이산화염소는 강력한 산화제로, 물 속의 유기물, 바이러스, 박테리아 등을 효과적으로 제거하거나 비활성화할 수 있습니다.
이산화염소 산화 공정
- 이산화염소 생성: 이산화염소는 현장에서 화학 반응을 통해 생성되거나, 액체 형태로 구매하여 사용됩니다. 현장에서는 보통 염소산나트륨과 염산을 반응시켜 이산화염소를 생성합니다.
- 물과의 반응: 생성된 이산화염소는 물에 주입되며, 이때 유기물, 바이러스, 박테리아 등과 반응하여 이들을 제거하거나 비활성화합니다.
- 산화: 이산화염소는 강력한 산화력을 가지고 있어, 물 속의 철, 망간과 같은 미네랄을 산화시켜 제거할 수 있습니다.
이산화염소 산화의 장단점
이산화염소 산화의 장점으로는 염소 대비 낮은 부산물 생성, 특정 미생물에 대한 높은 살균력, 그리고 물의 맛과 냄새 개선 등이 있습니다. 또한, 이산화염소는 일부 미생물에 대한 염소 저항성을 극복할 수 있는 능력을 가지고 있습니다.
그러나, 이산화염소는 취급 시 주의가 필요하며, 정확한 농도 조절이 중요합니다. 높은 농도에서는 독성이 있을 수 있으므로, 사용 시 안전 지침을 준수하는 것이 중요합니다. 이산화염소는 일부 특정한 유기물과 반응하여 유해한 부산물을 생성할 수도 있으므로, 수질 분석을 통한 적절한 관리가 필요합니다.
과망간산칼륨산화

과망간산칼륨(Potassium Permanganate, KMnO4) 산화는 물 처리 과정에서 주로 철, 망간, 황화수소 같은 불순물을 제거하는 데 사용되는 방법입니다.
과망간산칼륨은 강력한 산화제로, 물 속의 유기물 및 미생물을 산화시켜 제거하거나 비활성화시키는 데 효과적입니다.
과망간산칼륨 산화 과정
- 과망간산칼륨 첨가: 처리하고자 하는 물에 과망간산칼륨을 정량적으로 첨가합니다. 이때, 산화해야 할 물질의 양과 종류에 따라 필요한 과망간산칼륨의 양이 결정됩니다.
- 산화 반응: 과망간산칼륨이 물 속의 철, 망간, 유기물 등과 반응하여 이들을 산화물 형태로 변환시킵니다. 이 과정에서 철과 망간은 불용성 산화물로 변하므로, 후속 여과 과정을 통해 쉽게 제거할 수 있습니다.
- 여과 및 제거: 산화 반응을 통해 생성된 불용성 산화물들은 여과 과정을 통해 물로부터 분리 및 제거됩니다. 이를 통해 물의 맑기와 질이 개선됩니다.
과망간산칼륨 산화의 장단점
과망간산칼륨 산화의 장점은 강력한 산화력으로 다양한 불순물을 효과적으로 제거할 수 있다는 점입니다. 또한, 물의 색깔과 냄새를 개선하는 데에도 도움을 줍니다.
하지만, 과다 사용 시 물이 분홍색으로 변할 수 있으며, 과망간산칼륨 자체가 독성을 가질 수 있어 취급 시 주의가 필요합니다.
오존산화
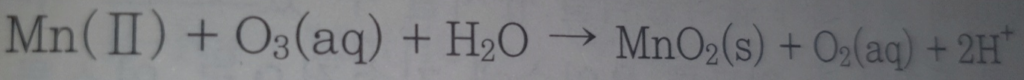
오존산화는 물 처리 과정에서 유기물 제거, 미생물 비활성화, 색과 냄새 개선 등을 위해 널리 사용되는 방법 중 하나입니다. 오존(O3)은 강력한 산화제로, 다양한 오염물질을 효과적으로 제거할 수 있습니다.
오존산화 과정
- 오존 생성: 오존은 보통 현장에서 전기분해(오존발생기를 사용하여 공기 또는 산소에서 직접 생성)를 통해 생성됩니다. 이때 고전압을 이용하여 산소 분자(O2)를 오존(O3)으로 변환시킵니다.
- 물과의 반응: 생성된 오존을 물에 주입하면 오존이 물속의 유기물, 미생물, 바이러스, 그리고 다른 오염물질과 반응하여 이들을 산화시키고 제거하거나 비활성화합니다.
- 산화 및 제거: 오존은 유기물을 산화시켜 미생물의 세포벽을 파괴하거나, 철과 망간과 같은 무기물질을 산화시켜 제거할 수 있습니다. 또한, 오존은 색과 냄새를 유발하는 물질을 효과적으로 개선할 수 있습니다.
오존산화의 장단점
오존산화의 장점으로는 강력한 산화 능력으로 빠르고 효과적으로 물을 처리할 수 있으며, 오존이 물속에서 빠르게 분해되어 잔류물을 남기지 않는다는 점이 있습니다. 이는 후속 처리 과정에서의 부담을 줄입니다.
그러나 오존은 높은 비용과 복잡한 시스템이 필요하며, 오존 발생기의 안전한 운영을 위해서는 주의가 필요합니다. 오존산화 과정에서는 부산물이 발생할 수도 있는데, 이는 오존과 유기물의 반응에 따라 다릅니다.
접촉여과법
망간사여과법
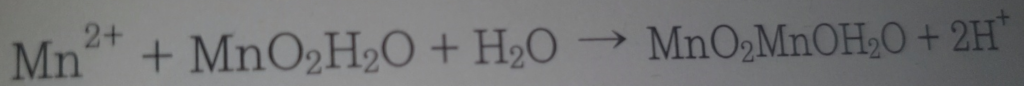
망간사여과법은 주로 식수나 폐수 처리에서 철과 망간을 제거하기 위해 사용되는 물 처리 과정 중 하나입니다. 이 방법은 철과 망간을 산화시키고, 이를 여과재를 사용하여 물리적으로 제거하는 과정을 포함합니다.
망간사여과법의 주요 단계
- 전처리: 물에 산화제를 첨가하여 물 속에 용해된 철과 망간을 산화시킵니다. 산화제로는 과망간산칼륨, 염소, 오존 등이 사용될 수 있습니다.
- 산화: 산화제가 철과 망간과 반응하여 이들을 산화시킵니다. 산화된 철과 망간은 불용성 형태로 변환되어 물에서 분리될 수 있게 됩니다.
- 여과: 산화 과정을 거친 후, 물은 여과 과정을 통해 처리됩니다. 여기서는 특별히 망간사(Manganese Greensand) 여과재를 사용하여 산화된 철과 망간을 포획하고 제거합니다. 망간사는 철과 망간을 효과적으로 포착할 수 있는 여과재로, 자체적으로도 약간의 산화 능력을 가지고 있습니다.
- 후처리: 여과된 물은 소독 과정을 거쳐 최종적으로 사용될 수 있게 됩니다. 이 단계에서는 물 속 남아있을 수 있는 미생물을 제거합니다.
망간사여과법의 장단점
망간사여과법의 장점으로는 철과 망간을 효과적으로 제거할 수 있다는 점과, 처리 과정이 비교적 간단하다는 점이 있습니다. 또한, 산화와 여과를 하나의 과정으로 통합하여 처리 효율을 높일 수 있습니다.
그러나, 망간사 여과재는 주기적인 재생이 필요하며, 재생 과정에서 적절한 조건과 산화제의 사용이 중요합니다. 재생 과정을 관리하기 위한 추가적인 시스템과 비용이 필요할 수 있습니다.
접촉여재여과법
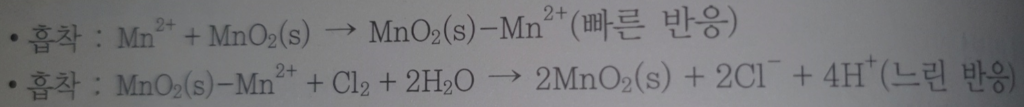
접촉여재여과법은 수처리 과정에서 사용되는 효율적인 방법 중 하나로, 특히 오염물질 제거와 수질 개선에 효과적입니다. 이 방법은 화학적 처리와 물리적 여과를 결합한 고급 여과 기술입니다.
접촉여재여과법의 주요 단계
- 화학처리: 우선, 수처리 과정에서 오염물질과 반응하여 이들을 제거하거나 변환시킬 수 있는 화학 물질(예: 응집제나 산화제)이 물에 첨가됩니다.
- 접촉: 첨가된 화학 물질이 특수한 여재와 접촉하면서 더 효과적으로 오염물질을 제거하거나 변환시키는 반응이 일어납니다. 이 때 사용되는 여재는 오염물질을 더 잘 붙잡아둘 수 있는 특성을 가지고 있습니다.
- 여과: 화학 처리를 거친 후, 물은 여과 과정을 통해 오염물질이 제거됩니다. 여기서 사용되는 여재는 일반적인 여과 재료보다 더 높은 오염물질 제거 효율을 보여줍니다.
- 처리된 물 회수: 여과 과정을 거친 물은 대부분의 오염물질이 제거되어 사용에 적합한 상태가 됩니다.
접촉여재여과법의 장점
화학적 처리와 물리적 여과를 결합하여 오염물질 제거 효율을 높일 수 있다는 점, 다양한 유형의 오염물질에 대응할 수 있다는 점 등이 있습니다.
이온교환법
망간이 물 속에 존재하는 이온의 형태로 존재할 때, 이온 교환 수지를 사용하여 망간 이온을 제거할 수 있습니다.
낮은 농도의 망간을 처리하는 데 효과적입니다.
1. Na 사이클의 망간제거 반응
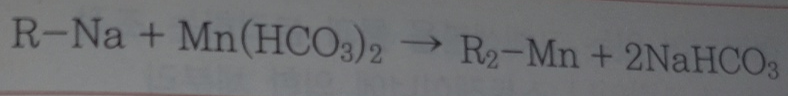
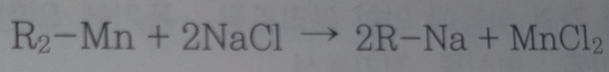
2. H+사이클의 망간제거 반응

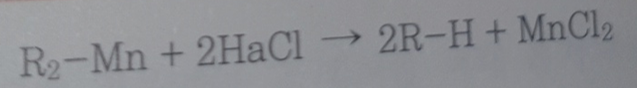
이온 교환법은 물 처리 과정에서 사용되는 기술로, 물 속의 원하지 않는 이온을 원하는 이온으로 교환하는 방법입니다.
주로 경수를 연수화하거나, 물 속의 중금속, 질산염, 아르세닉과 같은 유해한 물질을 제거하는 데 사용됩니다.
이온 교환 과정
- 이온 교환 수지: 이온 교환 과정의 핵심은 이온 교환 수지입니다. 이 수지는 특정 이온에 대해 높은 친화력을 가지며, 물 속의 원하지 않는 이온을 수지의 이온과 교환합니다.
- 재생 과정: 이온 교환 수지는 결국 포화 상태에 이르게 되며, 더 이상 이온을 교환할 수 없게 됩니다. 이때, 강한 용액을 사용하여 수지를 재생시키면, 수지는 다시 이온을 교환할 수 있는 상태로 복원됩니다.
- 처리 과정: 물은 이온 교환 수지를 통과하면서 원하지 않는 이온이 제거되고, 이를 원하는 이온으로 교환합니다. 예를 들어, 경수를 연수화하기 위해 칼슘 이온(Ca2+)과 마그네슘 이온(Mg2+)을 나트륨 이온(Na+)으로 교환할 수 있습니다.
이온교환법의 장단점
이온 교환법의 장점은 특정 이온을 매우 효과적으로 제거할 수 있다는 점입니다. 또한, 이 과정은 화학적으로 안정하며 장기간 사용이 가능합니다.
하지만, 이온 교환 수지의 재생 과정에는 화학 물질이 사용되며, 이는 환경에 부담을 줄 수 있습니다. 또한, 처리 과정에서 부산물이 발생할 수 있으므로, 적절한 관리와 유지가 필요합니다.
마무리
오늘은 망간(Mn) 제거 기법 6가지(산화법, 접촉여과법, 이온교환법 등)에 대해 알아보았습니다.
망간(Mn) 제거 기법은 원수로부터 망간을 제거하여 깨끗한 물을 얻는 과정을 말합니다. 주요 기법으로는 산화법, 접촉여과법, 이온교환법 등이 있습니다.
- 산화법: 망간을 불용성 화합물로 변환하고 분리합니다. 자연적인 공기 산화나 염소, 오존, 과망간산칼륨을 사용한 화학적 산화 등이 있습니다.
- 접촉여과법: 특수 필터를 사용하여 산화된 망간을 직접 제거합니다.
- 이온교환법: 이온교환 수지를 사용하여 망간 이온을 제거합니다. 낮은 농도의 망간 처리에 특히 효과적입니다.
그 외에도 역삼투(RO), 망간 전용 제거제 사용, 생물학적 처리 등이 있습니다.
배출수 처리시설의 종류, 배출수 처리과정과 고려사항 8가지
